Ce este stresul?
Termenul de stres se referă la răspunsul fiziologic al organismului la factorii (stresori) interni sau externi percepuți care au capacitatea de a-i perturba homeostazia (Bucsek, Giridharan, MacDonald, Hylander, & Repasky, 2018). Altfel spus, stresul se referă la totalitatea acelor evenimente care conțin stimuli (stresori) capabili să producă o reacție în creier (perceperea stresului) ce conduce la activarea răspunsului fiziologic de „luptă-sau-fugă” al organismului (răspunsul la stres) (Dhabhar, 2018). Activarea răspunsului la stres (care se realizează prin intermediul axei hipotalamo-hipofizo-corticosuprarenale – HHC – și a sistemului nervos simpatic – SNS -) determină o serie de modificări în aproape fiecare sistem al organismului, influențând starea și comportamentul individului (American Psychological Association, 2015).
Axa hipotalamo-hipofizo-corticosuprarenală
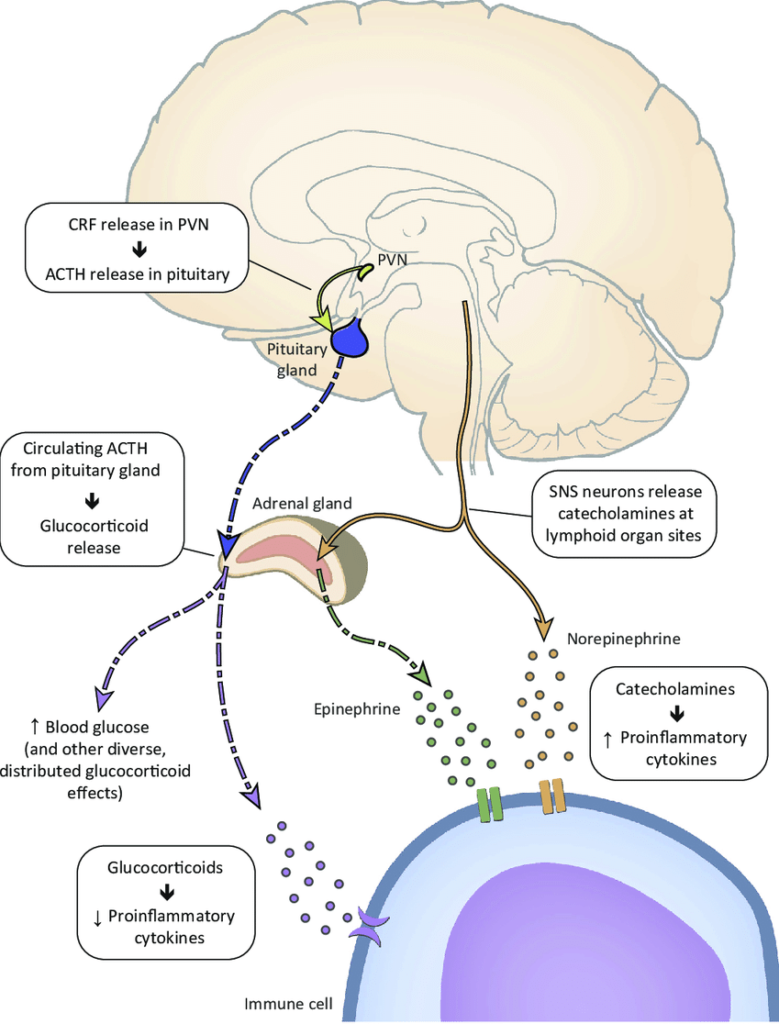
Perceperea unui factor stresor (unei amenințări) activează circuitele nervoase la nivel cortical, limbic și hipotalamic. Atunci când sistemul nervos central (SNC) este activat de către un factor stresor au loc două tipuri de răspunsuri: a) biologic (direct) și comportamental (indirect) (Biondi & Zannino, 1997). Activarea biologică a axei HHC și a SNS reprezintă mecanismul principal implicat în răspunsul biologic la stres: amigdala procesează răspunsul emoțional și transmite semnale către hipotalamus. Dacă semnalul primit din partea amigdalei indică o amenințare, hipotalamusul acționează ulterior în două modalități: a) prin activarea sistemului nervos simpatic și b) prin producerea hormonului eliberator de corticotropină (CRH). Atunci când sistemul nervos simpatic este activat, glandele suprarenale eliberează epinefrină și norepinefrină care mobilizează răspunsul de „luptă-sau-fugă”. Pe de altă parte, producerea de CRH activează eliberarea hormonului adrenocorticotropic (ACTH) din hipofiză, care activează apoi glandele suprarenale, determinând eliberarea cortizolului. În momentul în care factorul stresor dispare, cortizolul inhibă prin feedback negativ reacția de alarmă a organismului și eliberarea de catecolamine, restabilind homeostazia (Kaye & Lightman, 2017).
Stresul psihosocial și stresul fiziologic
Stresul poate fi atât psihologic (psihosocial), cât și fiziologic. În ambele cazuri, activitatea neuronală se produce într-un cluster care se extinde de la girusul frontal inferior la cortexul insular anterior. Cu toate acestea, procesarea celor două tipuri de stres depinde de regiuni neuronale distincte. Stresul fiziologic presupune o încercare de adaptare prin reducerea funcțiilor anumitor sisteme ale organismului (ex. sistemul digestiv) și prin activarea procesării senzorio-motorii și a memoriei de lucru auto-referențiale în vederea pregătirii reacției de luptă-sau-fugă. Pe de altă parte, stresul psihosocial necesită orientarea atenției asupra controlului cognitiv al emoțiilor, în vederea realizării unor acțiuni specifice care au ca scop îndeplinirea unor obiective (Kogler, et al., 2015).
Metilarea stresului
De asemenea, stresul psihosocial poate produce modificări fiziologice, neurochimice și hormonale care alterează funcțiile și structurile creierului, precum și ale diferitelor sisteme ale organismului. Keating (2019) a arătat chiar că evenimentele adverse din perioada intrauterină sau din primul an de viață pot cauza modificări biologice care afectează capacitatea individului de a-și gestiona stresul și anxietatea, fenomen pe care l-a numit „dereglarea nivelului de stres”. Aceste alterări biologice au loc la nivel epigenetic, modificând modalitatea de funcționare a genelor (metilare), fără a schimba însă structura ADN-ului. Deși copilăria și adolescența sunt considerate ca fiind perioade critice din acest punct de vedere, alterarea funcționalității axei HHC se poate produce oricând pe parcursul vieții, iar consecințele produse de tipul de stres sunt influențate de cronicitatea, severitatea, predictibilitatea și controlabilitatea factorilor stresori (Suri & Vaidya, 2015).
Stresul și bolile infecțioase
Pe lângă aceste efecte, stresul psihosocial poate altera funcțiile imune și poate prezice susceptibilitatea bolilor infecțioase, atât la animale, cât și la oameni (Cohen & Williamson, 1991; Biondi & Zannino, 1997; Yang & Glaser, 2000; Marsland et al., 2002; Miller & Cohen, 2017). Bolile infecțioase sunt provocate de agenți patogeni, microorganisme sau paraziți care pătrund în organism (sau care se află deja în acesta), care cresc și se multiplică în interiorul său și care pot fi sau nu contagioși. Infecția poate fi verificată din punct de vedere biologic prin stabilirea prezenței sau a procesului de replicare a unui agent infecțios în țesuturi, fluide sau în ambele. Totodată, prezența anticorpilor (i.e. molecule de proteine care se atașează de microorganismele invadatoare și care le marchează pentru a fi distruse și pentru a nu mai infecta alte celule) poate dovedi existența unei infecții (Cohen & Williamson, 1991). Deși acest articol vizează relația dintre stres și infecțiile virale ale căilor respiratorii superioare, în continuare voi oferi câteva explicații referitoare la modelul relațional general al stresului și al bolilor infecțioase, pentru ca cititorul să beneficieze de o scurtă introducere în psihoneuroimunologie.
Un modelul relațional general al stresului și al bolilor infecțioase
Evenimentele negative de viață și stările afective negative (distres emoțional) cu care se confruntă individul sunt considerate factori de stres psihosocial care pot cauza stări afective negative ce cresc riscul de dezvoltare a unei boli de natură infecțioasă. O modalitate prin care factorii stresori pot influența patogeneza unei boli constă în capacitatea lor de a crea stări afective negative. Acestea din urmă afectează în mod direct acele procese biologice și tipare comportamentale care intensifică riscul apariției unei boli (Ibid.). Totuși, Marsland et al. (2002) atrag atenția că nu toți indivizii care suferă de stres ajung să dezvolte o boală infecțioasă. Biondi & Zannino (1997) explică faptul că manifestările somatice și comportamentale care caracterizează reacțiile la stres nu sunt activate în mod direct de stresori, ci indirect de acțiunea acestora la nivelul sistemului nervos central (SNC). Activarea SNC de către factorul stresor implică apariția a două procese psihice: evaluarea cognitivă (a factorului stresor, adică a semnificației stimulului) și reacția emoțională (de exemplu, senzația de teamă).
În acest sens, Miller & Cohen (2017) au conceput un model explicativ al relațiilor dintre stres, căile mediatoare și bolile infecțioase, bazându-se pe teoria evaluării formării emoțiilor (Richard Lazarus): circumstanțele amenințătoare sunt evaluate de ființa umană în funcție de gradul de pericol și de gestionabilitatea acestora. Dacă individul evaluează factorii stresori ca fiind amenințători sau dacă este de părere că factorii respectivi depășesc capacitățile sale de coping, atunci are loc un răspuns psihologic la stres care este caracterizat de emoții și cogniții negative (nu neapărat disfuncționale). Stările produse de răspunsul psihologic la stres determină o serie de adaptări biologice și comportamentale al căror efect constă în creșterea susceptibilității la boală. Se pare că stimulii care necesită a fi elaborați la nivelul SNC au capacitatea de a spori sau de a reduce răspunsul imun al organismului, fenomen care poartă denumirea de „neuroimunomodulare” (Biondi & Zannino, 1997).

(Hiper)activarea sistemului nervos simpatic
Persoanele care suferă de stres manifestă și o (hiper)activare a sistemului nervos simpatic: fibrele simpatice (care pornesc din sistemul nervos central și care inervează organele limfoide) sunt activate de distres și produc eliberarea unor neurohormoni care pot ușura multiplicarea patogenilor și care se pot atașa de receptorii prezenți pe leucocite, influențându-le funcția imună (Miller & Cohen, 2017). Atunci când sistemul nervos simpatic este activat de stres are loc eliberarea de catecolamine din glandele suprarenale și din terminațiile nervilor simpatici. Celulele sistemului imunitar prezintă receptori adrenergici specifici pentru catecolamine, principalii receptori fiind cei β2-adrenergici. Aceștia se regăsesc atât pe celulele imune înnăscute, cât și pe celule imune dobândite, ambele fiind implicate în răspunsul imun la infecția produsă de agenții patogeni. Limfocitele din organism sunt suprimate de input-ul adrenergic, ceea ce le permite agenților patogeni să se multiplice (Bucsek et al., 2018).
În cadrul unui experiment de laborator, Manuck et al. (1991, apud. Marsland et al. 2002) au descoperit că doar participanții cu răspunsuri simpatice intensificate (măsurate prin reacțiile cardiovasculare și prin nivelul de catecolamine din sânge) au manifestat răspunsuri imune activate de sarcinile de laborator (stresori acuți): o creștere a numărului de celule T citotoxice (limfocite T citotoxice) și diminuarea răspunsului mitogenic la fitohemaglutinină (PHA). De asemenea, persoanele cu răspunsuri simpatice intensificate la stresori acuți au înregistrat și o creștere a nivelului de cortizol seric în comparație cu cei care nu prezintă astfel de răspunsuri (Cacioppo et al., 1998; Cohen et al., 2000, apud. Ibid.), iar cortizolul se asociază cu o diminuare a funcției imune celulare (Cacioppo et al., 1995, apud. Ibid.).
Activarea de către distres a sistemelor de răspuns hormonal din organismul uman determină eliberarea unor hormoni (cortizol, adrenalină, testosteron etc.) care pot cauza o creștere a susceptibilității bolii în două moduri diferite: a) prin facilitarea replicării sau a reactivării unor agenți patogeni (ex. infecții latente) și b) prin modificarea naturii răspunsului imunitar la infecție (Miller & Cohen, 2017). O perioadă de timp s-a crezut că acești hormoni reduc răspunsul imunitar și facilitează posibilitatea de multiplicare și răspândire a patogenilor. Însă există posibilitatea ca activitatea hormonilor de stres să producă mai degrabă o hiperreglare a răspunsul imunitar și o intensificare a producției de citokine inflamatorii care mediază și reglează răspunsurile imune și inflamațiile din organism (Ibid.) (un număr mult prea mare de citokine poate produce chiar decesul, precum în cazul pacienților bolnavi de Covid-19). Activitatea sistemului imunitar poate fi influențată de activarea de către stres a axei HHC, care conduce la eliberarea de hormoni neuroendocrini. Celulele limfoide (care se vor diferenția în limfocite) și mieloide (care se vor diferenția în eritrocite, leucocite sau trombocite) dețin receptori pentru hormonii neuroendocrini și pentru neuropeptide, fiind astfel activate sau inhibate de semnalele primite de la axa HHC. Celulele imunitare pot răspunde și semnalelor provenite de la axa simpato-adrenomedulară (SAM), ca urmare a faptului că beneficiază de receptori specifici pentru catecolamine. Eliberarea/inhibarea citokinelor inflamatorii (i. e. proteine solubile eliberate din celule) poate fi stimulată de către celulele imunitare, ceea ce intensifică producția de CRH la nivelul hipotalamusului. Eliberarea de CRH determină eliberarea de ACTH și corticosteron de către glanda piuitară și de cortexul glandei suprarenale, hormoni care pot deregla sau diminua răspunsul imun (Yang & Glaser, 2000).
Cercetări experimentale ce vizează relația dintre stres și infecțiile virale acute ale căilor respiratorii superioare
Într-un studiu desfășurat între 1986 și 1989, Cohen, Tyrell, & Smith (1991, apud. Miller & Cohen, 2017) au recrutat 420 de voluntari, cu vârste cuprinse între 18 și 54 de ani, sănătoși din punct de vedere clinic, dispuși să se infecteze cu un virus al răcelii comune (rinovirus 2, rinovirus 9, rinovirus 14, virusul respirator sincițial și coronavirus 229E) și să se carantineze pe parcursul experimentului în apartamentele puse la dispoziție de către cercetători. Voluntarii au fost carantinați cu două zile înainte de expunerea la virus, perioadă de timp în care au fost examinați fizic, au completat chestionare de stres psihologic, de comportamente de sănătate și demografice. Acestora le-au fost recoltate probe de sânge pentru evaluarea imunității preexistente la virus și culturi virale din secrețiile nazale la nivel de bază. Totodată, participanților le-au fost evaluate semnele și simptomele bolilor respiratorii. În cea de-a treia zi a experimentului a avut loc inocularea cu virusul răcelii comune. În următoarele șase zile de la inoculare, cercetătorii au recoltat secrețiile nazale pentru cultura virală și au evaluat semnele și simptomele bolii, urmând ca la patru săptămâni de la expunere să recolteze probe de sânge pentru măsurarea anticorpilor. Rezultatele acestei cercetări au arătat că subiecții care sufereau de stres au manifestat rate mult mai crescute de boală clinică decât cei care nu sufereau de stres. Aceste rezultate sunt valabile pentru stresul măsurat în stresul perceput, în afectul negativ, în indexul stresului și în evenimentele de viață. Stresul a fost asociat cu toate cele cinci virusuri ale răcelii, de unde Cohen, Tyrell, & Smith au dedus că relația dintre stres și infecțiile căilor respiratorii superioare ține mai degrabă de dereglarea răspunsului imunitar și nu de patogeneza virusului, iar Chester (1992, apud. Biondi & Zannino, 1997) a presupus că stresul afectează răspunsul imun prin alterarea mucoasei nazale, care are scopul de a proteja organismul de agenți patogeni.
În perioada 1993 – 1996 a avut loc un alt studiu asupra răcelii comune, în Pittsburgh. Cohen et al. (1998 apud. Miller & Cohen, 2017) au dezvolt o metodologie asemănătoare cercetării anterioare, cu următoarele modificări specifice: a) stresul a fost evaluat prin interviuri și nu prin chestionare; b) au fost adăugate teste pentru căile endocrine și imunitare; c) diagnosticarea bolii clinice s-a realizat pe baza semnelor obiective ale acesteia și nu pe baza evaluării unui medic. De data aceasta, eșantionul a fost compus din 276 de adulți, cu vârste cuprinse între 18 și 55 de ani, sănătoși din punct de vedere clinic. Voluntarii au fost carantinați cu 24 de ore înainte de fi inoculați cu (rino)virusul, iar apoi încă cinci zile, timp în care le-au fost recoltate probe din secrețiile nazale pentru verificarea infecției, au completat chestionare despre simptomele lor respiratorii și le-au fost testați cei doi markeri obiectivi ai bolii. Principalele rezultate ale cercetării au arătat că deși 179 din cei 276 de voluntari au suferit un eveniment acut sever pe parcursul anului precedent, nu au fost identificate corelații între evenimentele acute (de stres) și dezvoltarea răcelii. Pe de altă parte, 75 dintre participanți au manifestat simptome timp de o lună de la inoculare. Aceștia au înregistrat un risc de două ori mai mare de a dezvolta o formă de răceală decât ceilalți voluntari (chiar și când au fost controlate efectele sexului, etniei, nivelurilor de educație și masei corporale). De asemenea, participanții care se confruntau cu dificultăți interpersonale sau profesionale au prezentat un risc mai crescut de a dezvolta răceală în comparație cu cei care nu se confruntau cu astfel de probleme. Cohen și colegii săi au ajuns la concluzia că stresul cronic interpersonal (ex. conflicte în relațiile apropiate) și cel profesional (ex. șomajul) cresc riscul dezvoltării infecțiilor la nivelul tractului respirator superior. Cu cât stresorul este prezent mai mult timp, cu atât crește riscul de dezvoltare a bolii. Totodată, fumatul, lipsa exercițiilor fizice și o eficiență scăzută a somnului reprezintă factori de risc în dezvoltarea răcelii.
În anul 1998, la doi ani după studiul Pittsburgh asupra răcelii, Cohen, Doyle și Skoner (1999, apud. Ibid.) au repetat o altă cercetare, de această dată inoculându-le celor 55 de participanți, cu vârste cuprinse între 18 și 55 de ani, virusul gripal A/Kawasaki/86 H1N1. Respectând aproximativ aceeași metodologie (a fost adăugată măsurarea citokinelor prin intermediul testului de imunoabsorbție cu enzime legată – ELISA – ), rezultatele au arătat că scorurile pe care participanții le-au obținut în cadrul chestionarelor de simptome respiratorii au crescut direct proporțional cu stresul psihologic, la fel ca și masa de mucus. Nivelurile de IL-6 (citokină inflamatorie) au crescut pe parcursul primelor două zile de la inoculare, iar în cazul persoanelor stresate această creștere a fost direct proporțională cu scorurile stresului psihologic. Cohen și colegii săi consideră că IL-6 poate media asocierea dintre stres și felul în care se exprimă boala și că „stresorii hiperreglează răspunsul prin citokine față de patogeni invadatori, declanșând astfel simptomele bolii clinice. (…) cel puțin în cazul citokinelor proinflamatorii, este posibil ca stresorii să nu „surprime” răspunsul imunitar, ci să-l amplifice” (p. 479).
Alte cercetări din domeniul psihoneuroimunologiei au descoperit o corelație puternică între introversiune, stres și debutul bolilor produse de infecțiile respiratorii superioare. De exemplu, Broadbent et al. (1984, apud. Biondi & Zannino, 1997) au infestat 39 de voluntari cu rinovirus (RV9 sau RV9 și RV14) și alți 51 de voluntari cu virusul influenza (A Munich sau A California) și au descoperit că un nivel ridicat de introversiune se asociază cu o frecvență mai mare a infecției în cazul celor infectați cu rinovirus, dar și că stresul psihologic și obsesivitatea sunt factori predictivi ai dezvoltării simptomatologiei pentru acest grup. Pe de altă parte, Totman et al. (1980, apud. Cohen & Williamson, 1991) au descoperit că introverții manifestă o frecvență mai mare a infecțiilor, dar și o manifestare mai intensă a simptomatologiei (aspect pe care Brodbent et al. nu l-au identificat în cercetarea lor).
Clover et al. (1989, apud. Biondi & Zannino, 1997) au realizat o cercetare longitudinală pe un eșantion de 246 de participanți care formau un total de 58 de nuclee familiale, al cărei obiectiv principal a constat în identificarea rolului tipului de familie și stresului psihologic individual în dezvoltarea bolii produse (natural) de virusul gripal influenza. Înainte de sezonul rece, toți participanții au fost evaluați în legătură cu relațiile pe care le au în cadrul familiei și cu nivelul de stres individual. Acestora le-au fost măsurate și nivelurile de anticorpi din sânge, atât la început de sezon rece, cât și la finalul acestuia. Rezultatele cercetării realizate de Clover et al. au arătat că acei participanți care proveneau din familii stresate (ex. interacțiuni haotice și rigide) au înregistrat o incidență mai mare a bolii (clinic, serologic și microbiologic) în comparație cu cei care proveneau din familii non-stresate (ex. interacțiuni echilibrate), însă autorii nu au găsit nici o corelație între nivelul individual de stres și debutul/manifestările bolii.
Însă există și cercetări ale căror rezultate au arătat lipsa vreunei asocieri între stres și răspunsul imun. De exemplu, Locke & Heisel (1977, apud. Ibid.) au recrutat 124 de voluntari care au fost dispuși să fie inoculați cu o variantă inactivă a virusului influenza de tip A, însă nu au descoperit nici o corelație între variabilele psihologice evaluate și producția de anticorpi specifici. Greene et al. (1978, apud. Ibid.) au utilizat în studiul lor o variantă activă a virusului influenza de tip A, pe care l-au inoculat celor 33 de voluntari care au format eșantionul. La fel ca în cazul cercetării realizate de Locke & Heisel, Greene și colegii săi nu au reușit să identifice vreo corelație între variabilele psihologice evaluate (evenimente de viață stresante sau stări de dispoziție) și producția de anticorpi sau debutul bolii.
Cu toate acestea, Marsland et al. (2002) prezintă rezultatele a cinci cercetări publicate alături de colegii săi în perioada anilor 1992 – 1995 care au arătat că voluntarii expuși unor factori stresori în laborator (un exercițiu mental de aritmetică, un discurs evaluativ sau testul Stroop) au manifestat modificări la nivelul reacțiilor imune în fiecare dintre studii, comparativ cu cei care nu au fost supuși unor astfel de factori: o creștere semnificativă a numărului de celule natural killer (NK) (CD56+) și a numărului de celule citotoxice T (CD8+), alături de o scădere semnificativă a numărului de celule T helper și celule citotoxice T (CD4+:CD8+) și o scădere a răspunsului proliferativ la PHA și la concavalina A (Con A), fără însă a fi identificate modificări semnificative în ceea ce privește numărul celulelor B (CD19+) și celulelor T helper (CD4+). Marsland și colegii săi consideră că modificările cauzate de stresul acut în reacția imună sunt parțial mediate de hemoconcentrație, alături de reglarea receptorilor și citokinelor necesare îndeplinirii funcțiilor imunitare.
Într-o altă cercetare (Marsland et al., 2001, apud. Ibid.), 84 de persoane, cu vârste cuprinse între 20 și 35 de ani și sănătoase din punct de vedere clinic, s-au oferit voluntare pentru a le fi examinate reacțiile imune la vaccinul antihepatita B. Rezultatele cercetării au fost asemănătoare cu cele anterioare, în sensul că au fost descoperite asocieri între stresul acut și creșterea numărului de celule citotoxice T și celule NK, dar și între stresul acut și scăderea răspunsului proliferativ la PHA și Con A. Însă în această cercetare a fost identificată și o corelație între trăsătura de personalitate nevrotism și răspunsul imun la vaccin. Acei participanți care au obținut scoruri ridicate la trăsătura nevrotism au înregistrat răspunsuri mult mai reduse ale anticorpilor la cinci luni de la primul vaccin. Totodată, nivelurile ridicate de nevrotism și diminuarea proliferării celulelor T au reprezentat factori predictivi pentru un răspunsul redus al anticorpilor la vaccinul antihepatita B. Nivelul final de anticorpi a fost mult mai scăzut în cazul acelor voluntari care au manifestat, la cea de-a doua vaccinare, un răspuns imun redus în comparație cu cei care au manifestat un răspuns intensificat, ceea ce i-a condus pe autori la concluzia conform căreia participanții care au manifestat o reacție imună intensificată ca urmare a stresului acut tind să înregistreze o durată mult mai scăzută a perioadei de imunitate împotriva virusului hepatitei B în comparație cu voluntarii mai puțin imunoreactivi. Se pare că există posibilitatea ca stresul să afecteze și eficiența vaccinului împotriva Covid-19 (Madison, Shrout, Renna, & Kiecolt-Glaser, 2021), însă mai sunt necesare și alte cercetări pentru a putea dezbate pe larg acest subiect.
Având în vedere toate aceste informații, putem afirma că stresul psihologic are capacitatea de a influența răspunsul imun al organismului în raport cu debutul, manifestările și efectele infecțiilor virale acute ale căilor respiratorii superioare, dar și de a prezice susceptibilitatea bolilor infecțioase.
Text scris de Radu Mihai.
Vă rugăm să citați acest articol în felul următor: Mihai, R. (2021, Ianuarie 26). Psihoneuroimunologie: Stresul și bolile infecțioase (Partea I: Infecțiile virale acute ale căilor respiratorii superioare). Retrieved from Lumen in mundo: https://lumeninmundo.com/2021/01/26/psihoneuroimunologie-stresul-si-bolile-infectioase-partea-i-infectiile-virale-acute-ale-cailor-respiratorii-superioare/
Surse bibliografice:
American Psychological Association. (2015). APA Dictionary of Psychology. Washington, DC: American Psychological Association.
Biondi, M., & Zannino, L.-G. (1997). Psychological Stress, Neuroimmunomodulation, and Suceptibility to Infectious Diseases in Animals and Man: A Review. Psychotherapy and Psychosomatics, 66, (3), 3 – 26.
Bucsek, J. M., Giridharan, T., MacDonald, R. C., Hylander, L. B., & Repasky, A. E. (2018). An overview of the role of sympathetic regulation of immune responses in infectious disease and autoimmunity. International Journal of Hyperthermia, 34, (2), 135 – 143.
Cohen, S., & Williamson, M. G. (1991). Stress and Infectious Disease in Humans. Psychological Bulletin, 109, (1), 5 – 24.
Dhabhar, S. F. (2018). The Short-Term Stress Response – Mother Nature`s Mechanism for Enhancing Protection and Performance Under Conditions of Threat, Challenge, and Opportunity. Frontiers in Neuroendocrinology, 49, 175 – 193.
Kaye, M. J., & Lightman, L. S. (2017). Stresul psihologic și axele endocrine. În K. Vedhara, & R. M. Irwin, Psihoneuroimunologie umană (pg. 56 – 106). București: Editura Trei.
Keating, P. D. (2019). Născut anxios: scapă de impactul dificultăților din primii ani de viață. București: Curtea Veche.
Kogler, L., Mueller, I. V., Chang, A., Eickhoff, B. S., Fox, T. P., Gur, C. R., & Derntl, B. (2015). Psychosocial versus physiological stress – meta-analyses on deactivations and activations of the neural correlates of stress reaction. NeuroImage, 119, 235 – 251.
Madison, A. A., Shrout, M. R., Renna, M. E., & Kiecolt-Glaser, J. K. (2021). Psychological and Behavioral Predictors of Vaccine Efficacy: Considerations for COVID-19. Perspectives on Psychological Science.
Marsland, L. A., Bachen, A. E., Cohen, S., Rabin, B., & Manuck, B. S. (2002). Stress, immune reactivity and susceptibility to infectious disease. Physiology & Behavior, 77, 711 – 716.
Miller, E. G., & Cohen, S. (2017). Bolile infecțioase și psihoneuroimunologia. În K. Vedhara, & R. M. Irwin, Psihoneuroimunologie umană (pg. 404 – 447). București: Editura Trei.
Suri, D., & Vaidya, V. A. (2015). The adaptative and maladaptive continuum of stress responses – a hippocampal perspective. Reviews in the Neurosciences, 26, (4), 415 – 442.
Yang, E. V., & Glaser, R. (2000). Stress-induced immunomodulation: impact on immune defenses against infectious disease. Biomedicine & Pharmacotherapy, 54, 245 – 250.
Sursă foto #1: zellx.de/hpa-axis/
Sursă foto #2: Miller, E. G., & Cohen, S. (2017). Bolile infecțioase și psihoneuroimunologia. În K. Vedhara, & R. M. Irwin, Psihoneuroimunologie umană, p. 410
Sursă foto #3: researchgate.net/figure/Neuroendocrine-and-Inflammatory-Stress-Responses-The-hypothalamic-paraventricular_fig2_328271382
Sursă foto #4: nature.com/articles/nri1571
Sursă imagine reprezentativă: economictimes.indiatimes.com






Pingback: ,,De ce se îmbolnăvesc oamenii?’’ se întreabă Darian Leader și David Corfield – Lumen in mundo
Pingback: Teoria lui Babette Rothschild despre cum „corpul își amintește” experiențele traumatice și modalități de intervenție psihoterapeutică în traumă – Lumen in mundo
Pingback: Intestine deprimate: rolul bacteriilor microbiomului intestinal în apariția și tratamentul depresiei – Lumen in mundo